Modelo computacional ajuda tratamento do cancro
Por: Cristina Pinto / Universidade de Coimbra
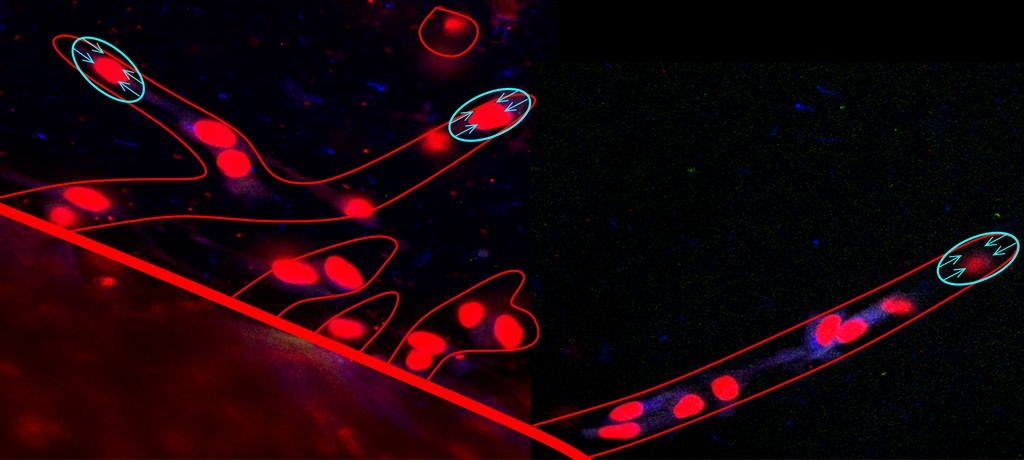
O investigador Rui Travasso, do Departamento de Física da Universidade de Coimbra (UC), liderou uma equipa interdisciplinar internacional que simulou o crescimento de vasos sanguíneos que ocorre durante o desenvolvimento de um tumor, permitindo esclarecer como a proliferação das células dos vasos sanguíneos é regulada durante o crescimento vascular.
Este trabalho, financiado pela Fundação para a Ciência e Tecnologia (FCT), envolveu físicos, engenheiros biomédicos, médicos e biólogos no desenvolvimento de um modelo computacional quantitativo que descreve o crescimento de novos vasos sanguíneos e terá importantes implicações no desenvolvimento de novos tratamentos para o cancro e não só.
«Este modelo computacional, desenvolvido a partir de experiências realizadas pelos grupos coordenados por Henrique Girão e Raquel Seiça, da Faculdade de Medicina da UC, demonstrou pela primeira vez como a proliferação das células que compõem os vasos sanguíneos depende da tensão mecânica a que está sujeito o novo vaso durante o seu crescimento», sublinha o líder do estudo.
Rui Travasso explica que «entender em detalhe como os vasos sanguíneos crescem é essencial para controlar o crescimento tumoral. O desenvolvimento de vários tumores e de diversas patologias como a retinopatia diabética alicerça-se num rápido crescimento da vasculatura sanguínea. No caso do cancro, estes novos vasos são os responsáveis por levar ao tumor os nutrientes necessários à sua rápida proliferação».
Por esta razão, prossegue o investigador da Faculdade Ciências e Tecnologia da UC, «várias terapias são desenvolvidas com vista a diminuir a vasculatura à volta das lesões tumorais. Apesar de terem bons resultados estas terapias são bastante onerosas, sendo por isso importante desenvolver novas estratégias para controlar a vascularização e a chegada de nutrientes ao tumor.»
O conhecimento dos membros da equipa sobre a biologia e a física do sistema foi essencial no desenvolvimento desta pesquisa, já publicada na PLoS Computational Biology. Na realidade, este novo modelo computacional integra não só os sinais biológicos presentes no desenvolvimento de vascularização patológica, mas também a rigidez do tecido onde os vasos crescem e as forças exercidas pelas diferentes células do sistema.
Rui Travasso clarifica que «só assim foi possível verificar qual o papel da rigidez do tecido e das tensões mecânicas no desenvolvimento da vasculatura. Este trabalho tem como consequência a possibilidade de se utilizarem alterações nas propriedades físicas dos tecidos para dificultar o crescimento dos vasos num tumor.»
Estas simulações computacionais «foram possíveis graças ao investimento realizado na maior unidade de supercomputação do país, que está sediada na UC», conclui o investigador.
Cristina Pinto (Assessoria de Imprensa - Universidade de Coimbra)
© 2015 - Ciência na Imprensa Regional / Ciência Viva
Cristina Pinto / Universidade de Coimbra
Veja outros artigos deste/a autor/a.
Escreva ao autor deste texto
Ficheiros para download Jornais que já efectuaram download deste artigo

