Mais um passo para a utilização do hidrogénio como fonte de energia alternativa
Por: ITQB NOVA - Gabinete de Comunicação
Investigadores do ITQB NOVA da Universidade NOVA de Lisboa, têm vindo a estudar um grupo especial de enzimas que produzem hidrogénio, que são particularmente interessantes por terem uma elevada produtividade de hidrogénio e maior tolerância à inactivação pelo oxigénio. Num estudo publicado dia 20 de Março de 2017 na revista Nature Chemical Biology estes investigadores desvendam o papel essencial que o átomo de selénio no centro activo da enzima desempenha na sua actividade.
O hidrogénio é uma fonte de energia muito atraente porque fornece mais energia de combustão do que qualquer outro combustível, e a sua utilização gera apenas vapor de água tornando-o um combustível limpo e sem impacto ambiental. No entanto, existem várias questões técnicas que têm dificultado a implementação de uma economia sustentável baseada no hidrogénio, como as dificuldades de transporte e armazenamento.
Na natureza, o hidrogénio é produzido por um grupo de proteínas chamadas hidrogenases. Estas enzimas promovem a reacção química mais simples de todas: juntar dois protões e dois electrões para formar uma molécula de hidrogénio, o elemento mais pequeno da tabela periódica. Mas esta simplicidade é aparente, pois em termos químicos esta reacção é extremamente díficil e requer o fornecimento de grandes quantidades de energia. É por isso um desafio perceber como as hidrogenases conseguem funcionar em condições suaves e de baixa energia, para que estas enzimas possam vir a ser usadas para produzir hidrogénio a partir de fontes renováveis, como a solar, ou para produzir electricidade a partir do hidrogénio.
As enzimas evoluíram ao longo de milhões de anos para optimizar a sua função e desempenham-na, em geral muito melhor do que a tecnologia humana. As hidrogenases usam metais baratos para fazer à temperatura ambiente o que as células de combustível só conseguem a altas temperaturas e utilizando a platina, um metal muito caro. Ao adaptar o mecanismo desta enzima à tecnologia será possível fazer pilhas de combustível mais baratas e consequentemente produzir hidrogénio barato a partir de eletricidade.
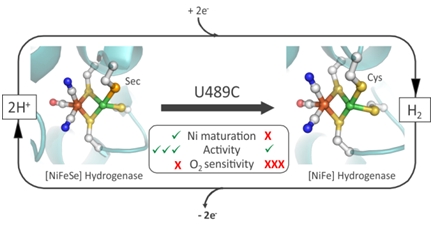
"Já sabíamos que o selénio era muito importante para a actividade desta hidrogenase, mas não sabíamos exactamente quanto, nem porquê. O que fizemos para perceber o seu papel foi usar a engenharia de proteínas para substituir o selénio por um elemento semelhante, o enxofre, e ver o que acontecia", conta Inês Cardoso Pereira, autora principal do trabalho juntamente com Pedro Matias. "Depois determinámos a estrutura molecular deste variante em diferentes condições de exposição ao oxigénio, o que nos permitiu ver quais as mudanças provocadas pela substituição daquele átomo.” “Tornou-se óbvio que na ausência de selénio os danos causados pelo oxigénio são muito mais severos e irreversíveis”, completa o cristalógrafo Pedro Matias.
“Uma descoberta inesperada e entusiasmante foi também perceber que sem selénio a enzima não consegue sequer incorporar o níquel de que precisa para funcionar, o que é uma revelação importante para percebermos como se dá a biossíntese desta molécula, partindo de uma sequência de aminoácidos até à sua estrutura final” explicou Inês Cardoso Pereira. No entanto, este facto trouxe um grau de dificuldade acrescida a este estudo, pois exigiu a incorporação in vitro do níquel para se poder obter uma enzima funcional. “Este obstáculo foi difícil de ultrapassar, e foi só devido à dedicação e trabalho árduo da aluna de doutoramento Marta C. Marques, que isso foi possível” reconhece a investigadora.
A equipa do ITQB NOVA trabalha também no desenvolvimento de aplicações biocatalíticas desta enzima, em conjunto com colaboradores do Instituto de Catálise CSIC em Madrid (laboratório de Antonio de Lacey). Em 2016 foram obtidos resultados muito promissores do uso da hidrogenase de [NiFeSe] na produção fotocatalítica de hidrogénio e na produção electroquímica de ATP, os quais foram também publicados em revistas científicas de alto impacto.
Artigo original
Marta C. Marques, Cristina Tapia, Oscar Gutiérrez-Sanz, Ana Raquel Ramos, Kimberly L. Keller, Judy D. Wall, Antonio L. De Lacey, Pedro M. Matias*, Inês A. C. Pereira*
The direct role of selenocysteine in [NiFeSe] hydrogenase maturation and catalysis Nature Chemical Biology, 2007 doi:10.1038/nchembio.2335
www.nature.com/nchembio/journal/vaop/ncurrent/full/nchembio.2335.html
ITQB NOVA – Gabinete de Comunicação
© 2017 - Ciência na Imprensa Regional / Ciência Viva
ITQB NOVA - Gabinete de Comunicação
O Instituto de Tecnologia Química e Biológica, Oeiras, é um instituto de investigação e formação avançada da Universidade Nova de Lisboa. Tem como missão fazer investigação científica e promover formação avançada em Ciências da Vida, Química e Tecnologias associadas, para benefício da saúde humana e do ambiente.
Veja outros artigos deste/a autor/a.
Escreva ao autor deste texto
Ficheiros para download Jornais que já efectuaram download deste artigo

